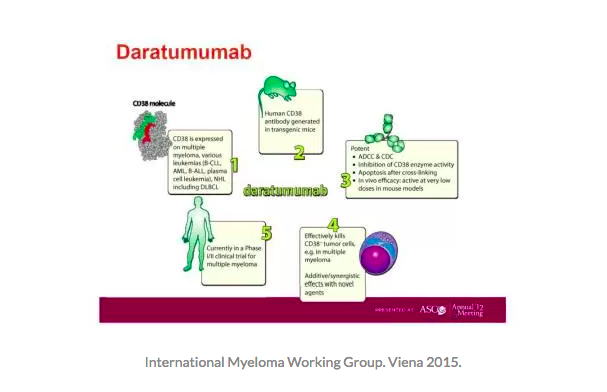
EL Dr. Plesner participó en el primer estudio sobre daratumumab (Darzalex). Describe la historia de sus orígenes, y el lento comienzo para garantizar la máxima seguridad en los primeros ensayos clínicos. El Dr. Plesner comparte consejos sobre cómo usar daratumumab en la clínica y un nuevo hallazgo en el que nos explica como daratumumab puede eliminar aquellas células reguladoras que impiden que el sistema inmunológico actúe, dejándolo libre para hacer su trabajo. Esta puede ser la razón por la que ayuda en la respuesta a más largo plazo. Se sugiere que la dexametasona es una buena compañera para reducir las reacciones relacionadas con la infusión. El Dr. Plesner comparte cómo daratumumb puede afectar a la pérdida de la determinación del grupo sanguíneo mientras los pacientes están en tratamiento y cómo también puede afectar a la monitorización de los niveles de enfermedad de un paciente. Los médicos y pacientes deben saber que puede reflejarse enfermedad mínima residual aunque no sea así . Nos hablará acerca de las mejores combinaciones posibles y usos de este nuevo fármaco.
El Dr. Torben Plesner es profesor y jefe del Departamento de Hematología en el Hospital Vejle en Dinamarca. Fundador de la Unidad de Investigación Clínica en el hospital y participa en el consejo, junta, comisión y redes de la European Hematology Association y del Myeloma European Network.

Prof.Troben Plesner
COMO EMPEZÓ TODO
Jenny: tal vez quiere hablarnos un poco sobre los antecedentes de daratumumab y cómo se involucró en su estudio y contarnos cómo ha sido su progreso y hasta donde hemos llegado.
Dr. Plesner: Usted sabe que yo creo que he sido muy afortunado por participar en este estudio. Tiempo atrás, coincidí con gente de la pequeña empresa danesa, Genemabm que ha desarrollado 20 anticuerpos para el linfoma y CLL y firmé con ellos, habían llevado a cabo ensayos clínicos de los anticuerpos CD20 y estaban satisfechos con la calidad encontrada durante el ensayo y luego se había desarrollado este nuevo anticuerpo tan interesante, el CD38 que ahora se conoce como daratumumab. Todo esto sucedió en los primeros días del año año 2007 cuando se me acercaron con esta idea de utilizar anticuerpos CD38 y debo decir que les advertí que era contrario a esta idea ya que pensé que esto sería potencialmente peligroso.
La razón es que la molécula CD38 esta ampliamente expresada en el cuerpo humano, no creo que podamos hablar de alguna célula que no tenga CD38. Por ejemplo, el sistema nervioso central, el corazón, los músculos, un montón de células en el cuerpo, las células hematopoyéticas, las plaquetas, las células rojas de la sangre, células blancas de la sangre, todos tienen CD38 por lo que fue realmente interesante esta idea aportada por Genemab y tenían datos pre-médicos de su laboratorio en Holanda donde mostraban una actividad muy alta de este anticuerpo.
Ellos querían avanzar por lo que decidimos realizar un programa de Fase I muy cuidadoso , donde se aplicó el anticuerpo para el primer paciente en dosis extremadamente bajas, muy bajas, y se controló de forma meticulosa a los paciente. Se les administró una sola vez y se observaron durante tres semanas para ver si había señales de efectos secundarios y después tuvieron una segunda dosis y entonces podrían continuar con la dosificación semanal ,como lo hacemos ahora, pero sólo después de un estricto período de observación se nos permitió dar el siguiente paso con un paciente en el ensayo.
Y luego vino el segundo y después de un tiempo el tercero pero fue realmente un progreso muy lento ya que teníamos este problema tan grande de seguridad sobre nuestras espaldas así que tuvimos que estar moviéndonos de forma muy cuidadosa y lo hicimos, pero poco a poco fuimos ganando confianza y vimos que por lo menos la dosificación más baja no era perjudicial, así que podríamos aumentar gradualmente la dosis del anticuerpo y todavía no había señal de actividad efectiva ya que seguían trabajando en dosis muy bajas y se estaba empezando a perder el interés porque nada estaba sucediendo, ningún daño, pero tampoco ningún beneficio, hasta que pasamos a 2 mg/kg de peso corporal. Después de este nivel de dosis y subiendo hasta cuatro, ocho y dieciséis , empezamos a ver señales de actividad anti-mieloma y tan pronto como eso ocurrió el escenario cambió totalmente : de esa sensación de tener un anticuerpo que podría ser perjudicial y, probablemente,no eficiente pasamos a todo lo contrario, todo el mundo pudo ver que estaba sucediendo algo que podría ser muy grande.
Y el trabajo se aceleró e incluyó una dosis del anticuerpo como agente único que se utilizó en el primer estudio de daratumumab ,con nada más y luego se añadió dexametasona para hacer frente a las reacciones relacionadas con la infusión. En este momento, en torno a dos miligramos por kilo, se planificó un estudio de combinación porque era evidente que un solo agente, una sola droga no sería capaz de lograr algo duradero para el mieloma, así que tuvimos que pensar en combinaciones y la primera fue daratumumab, lenalidomida + dexametasona. La razón es que los datos preclínicos del experimento que tenia Genemab en Holanda mostraban la sinergia existente entre daratumumab y lenalidomida.
Así que ese fue el primer agente para combinar con daratumumab. Pensamos que el segundo sería bortezomib a través de las tres fases del ensayo clínico.Las combinaciones se han utilizado en el mieloma múltiple refractario y estas combinaciones se han explorado en la configuración de recién diagnosticado con otros pacientes. Ha sido un largo periodo de prueba muy, muy gratificante el de daratumumab.
Y hay que decir que tuvimos datos preclínicos muy, muy sólidos y también las ideas procedentes de Genemab que son expertos en la producción de anticuerpos, que producen anticuerpos de muy alta calidad humanos, así que no es humanizado, es humano desde el comienzo. Pero esta pequeña empresa danesa / holandesa no tenía fuerza para afrontar los ensayos clínicos de fase III de un fármaco . Se necesitaba un gran capital financiero, estructura para hacer los ensayos clínicos, por lo que se asociaron con Janssen que ha resultado ser un gran, gran socio en el desarrollo de este medicamento.
Janssen es fuerte, tienen experiencia en el mieloma, es una empresa farmacéutica muy abierta y académica. Escuchan a los innovadores, escuchan las observaciones, escuchan las nuevas ideas e interactúan con nosotros de una forma muy abierta por lo que hemos sido capaces de lograr un avance muy significativo debido a esta asociación entre la industria farmacéutica, el mundo académico y el ámbito clínico
Como usted sabe, los estudios preclínicos han demostrado que daratumumab puede acabar con las células de mieloma junto con un complemento (factor citolítico), con células natural killers ADCC y por fagocitosis , donde acaban con las células de mieloma y son destruidos por los macrófagos, – en los tres casos mediante la unión de la molécula CD38 en las células de mieloma y la activación de estos diversos mecanismos de destrucción.
Pero una observación muy importante y muy reciente: daratumumab elimina algunas células reguladoras que frenan al sistema inmunológico, por lo que estas células reguladoras son eliminadas ya que también expresan CD38 y liberan células T citotóxicas.
Así que lo que vemos en los pacientes tratados con daratumumab es un mayor número de células T citotóxicas que se están expandiendo en lo que llamamos picos clonales. Podemos ver que son muy activas, y pensamos que son las células T anti-mieloma.Todo esto ha sido publicado muy recientemente en la revista Blood.
Jenny: Bueno, para mí esto es sólo un ejemplo perfecto del proceso de creación, largo proceso por otra parte, me refiero a que dijo que era nuevo en 2007 y estamos en el 2016
Dr. Plesner: Y ensayos gratificantes.
Jenny: increíble, es totalmente increíble, pero es por eso que se necesita mucho tiempo porque hay que tener cuidado y obviamente se ha tenido.
Dr. Plesner: Cuando nos embarcamos en nuevos ensayos clínicos, la seguridad del paciente es siempre la primera preocupación por lo que no puede haber daño, tenemos que estar seguros de que no estamos haciendo daño.
Creo que los primeros pacientes que entraron en los primeros ensayos, la Fase I de daratumumab fueron extremadamente valientes porque se les dijo que estábamos dosificando la medida hasta dosis extremadamente bajas por lo que probablemente no sería eficaz, lo que potencialmente podría ser peligroso, posiblemente muy peligroso, pero aceptaron de todos modos.
Así que a través de la prueba hemos encontrado la dosificación necesaria y allanado el camino para otros pacientes que podrán beneficiarse de este tratamiento. Así que estamos muy contentos y agradeciendo a muchos, muchos pacientes idealistas que realmente tuvieron la posibilidad de participar en esta prueba o conjunto de pruebas y allanaron el camino para el progreso que estamos viendo ahora.
Jenny: increíble, es increíble, el esfuerzo que se necesita tanto de los científicos y las compañías farmacéuticas como de los pacientes para poder unirse. Así que vamos a hablar un poco acerca de las combinaciones. Usted ha hablado de la combinación de lenalidomida y dexamentasona con daratumumab, he oído a otros médicos, que lenalidomida tiene un efecto de estimulación del sistema inmune, por lo que ¿se puede hablar del efecto sobre el sistema inmunológico con daratumumab combinado con lenalidomida y dexamentasona?
Dr. Plesner: Yo estaría feliz. Ha habido un montón de preocupaciones acerca de los posibles efectos antagónicos de administración de la dexametasona cuando se desea utilizar un anticuerpo y los mecanismos inmunes que se complementan para matar las células de mieloma. Se podría pensar que la dexametasona no sería buena, pero por otro lado si lo es para la reacción relacionada con la infusión tanto la dexametasona como la prednisona o algún otro esteroide para hacer frente a estas reacciones que puede provocar la infusión. Así que no se puede evitar por completo el esteroide. Daratumumab como agente único necesita un poco de esteroides . En realidad, no tenemos ninguna señal de que haya sido perjudicial. Por el contrario si nos fijamos en las combinaciones de lenalidomida y dexametasona o bortezomib y dexametasona, al agregar la dexametasona, a la lenalidomida o bortezomib, entonces se duplican las tasas de respuesta. Así que la dexametasona y otros esteroides son agentes anti-mieloma realmente eficaces por sí mismos. Podría depender del nivel de dosis, pero en realidad son agentes anti-mieloma y pueden contribuir muy significativamente a la muerte de las células de mieloma. Por lo que hay dos efectos iniciales de los esteroides – que han de tener el control de las reacciones relacionadas con la infusión y tiene los efectos anti-mieloma que contribuyen a lo que se consigue con daratumumab y lenalidomida o bortezomib.
Jenny: Eso es muy interesante porque sé que muchos pacientes le gustaría deshacerse de la dexametasona, pero cada vez que hacemos esa pregunta nos planteamos que es tan eficaz que no sería una buena idea eliminarla.
Dr. Plesner: ¿Qué podemos hacer en la práctica clínica? comenzamos con lo que llamamos la dosis completa de dexametasona para conseguir una respuesta. Así que si tengo una buena respuesta clínica, me gustaría empezar a conocer más los efectos secundarios de los que el paciente pueda quejarse , y si empezamos con la dosis completa luego podemos negociar una cantidad.
De hecho tengo pacientes ahora que comenzaron con la combinación de daratmumab, lenalidomida + dexametasona y están en RC estricta (respuesta completa) y después de dos años empiezan a quejarse sobre los efectos secundarios procedentes de lenalidomida y dexamentasona, así que les quito eso y sólo les doy daratumumab y un poco de esteroide para la infusión . Así que eso es posible, pero debe conseguir una buena respuesta, un buen control de la enfermedad antes de cambiar. Seguir adelante con el protocolo completo, tener una buena respuesta y entonces se puede negociar.
Jenny: Bueno, eso algo muy bueno en cualquier tratamiento de cualquier tipo, se puede hablar con su médico acerca de la dosificación en todo momento para ver si hay alguna flexibilidad en lo que se puede pedir que hagan si va a tener efectos secundarios importantes, así que creo que eso es bueno. Otra pregunta es, ¿qué otras combinaciones están siendo consideradas? , sobre todo con los checkpoints y otras cosas por el estilo. ¿Qué otros tipos de estrategias está considerando?
Dr. Plesner: En realidad tenemos ahora un ensayo clínico patrocinado por Celgene que está planteado para combinar daratumumab con durvalumab, un anticuerpo anti-PDL1 y si los pacientes no responden a esta combinación, entonces deben añadir pomalidomida. Tenemos que ser consciente del hecho de que la actividad de estos anticuerpos es completamente diferentes. Sabemos que daratumumab puede matar a las células de mieloma través de la activación del complemento y mediante la interacción con las células natural killers o macrófagos pero recientemente se ha encontrado también que daratumumab puede liberar un freno impuesto en el sistema inmune por las células de mieloma. El freno consiste en las llamados células reguladoras que inhiben el crecimiento y la actividad de linfocitos T citotóxicos. Cuando se suelta el freno mediante el tratamiento con daratumumab los linfocitos T citotóxicos crecen y se vuelven activos y creemos que esta reactivación del sistema inmune es importaste para el control de la enfermedad a largo plazo. Los checkpoints son un grupo de anticuerpos que pueden inactivar un escudo protector alrededor de las células de mieloma mediante la unión a la molécula de PD-1 en linfocitos T citotóxicos o la molécula de PD-L1 en células de mieloma. Cuando cualquiera de la PD-1 o PD-L1 están cubiertos por el anticuerpo de las células de mieloma ya no pueden matar o acercarse a los linfocitos T citotóxicos por estos se matan a si mismos. De este modo, tanto por la liberación de los linfocitos T con daratumumab y la protección de los linfocitos T ,las células de mieloma pueden ser erradicadas de manera efectiva. La viabilidad de tratar a los pacientes al mismo tiempo con dos anticuerpos diferentes, daratumumab y anti-PD-1 o PD-L1 se está estudiando en ensayos clínicos.
Así que la célula de mieloma tiene un escudo alrededor de sí misma en el que puede matar a las células T que se acercan a ella y esta parte del mecanismo se elimina con el checkpoint y el anti PDL-1, anticuerpo anti-mieloma. La acción de daratmumab provoca una liberación del freno del sistema inmunitario para que las células T pueden expandirse y acercarse a las células del mieloma y luego protegen las células T de deseaparecer a manos de las células de mieloma con el checkpoint.
Así que en teoría, la combinación del checkpoint y daratmumab podría ser realmente interesante. Está actualmente en ensayos clínicos. Así que para otras combinaciones creo que pomalidomida sería evidente para daratmumab, un inhibidor del proteasoma muy eficaz y carfilzomb, puede ser también probable. Tenemos que ver la seguridad de esta combinación. Pero si se piensa en la forma en que la supervivencia ha mejorado para los pacientes con mieloma se puede imaginar que en la comunidad de médicos y ciencias clínicas vemos como la duración de la vida de los pacientes también está aumentando rápidamente y estamos empezando a hablar de una cura para el mieloma múltiple.
Y los ensayos se están diseñando ahora para tratar de abordar esta situación en la que realmente podemos pensar en la curación de los pacientes con mieloma y creo que para los ensayos hemos de pensar en daratmumab, carfilzomib, dexametasona y lenalidomida y dexametasona. Esas combinaciones van a ser muy importa.ntes
Jenny: ¿Y qué tipo de terapia?
Dr. Plesner : la terapia de alta dosis y trasplante autólogo.
Jenny: Oh, ok.
Dr. Plesner: : Lo que no es tan popular en los Estados Unidos. En Europa todavía tenemos para los pacientes más jóvenes melfalán de dosis altas y trasplante autólogo de células madre como un tratamiento prioritario.
Jenny: Sí, creo que el trasplante es todavía un tratamiento básico. Así que dos preguntas acerca de eso, ¿hay algún estudio clínico con daratumumab y carfilzomib juntos en este momento?
carfilzomib
Dr. Plesner: No sé si se han inscrito ya los primeros pacientes , pero hay planes para que esto suceda ya. Fui a la reunión de la Myeloma European Network el fin de semana y se nos presentó un plan muy específico para un ensayo para los pacientes más jóvenes y lo elegimos para ellos . Yo sé que el Grupo Español del Mieloma es muy activo y ha estado planeando esto con varias empresas por lo que podría estar en curso ahora. Por lo tanto, muy, muy pronto.
Jenny : OK, así que lo investigaremos, porque nos hemos asociado con un buscador de ensayos clínicos llamado Spark Cures y ayuda a los pacientes con mieloma en los Estados Unidos a encontrar los ensayos clínicos más fácilmente porque está en un lenguaje sencillo y simplificado para que la gente sea capaz de encontrar y unirse a los ensayos clínicos y creo que una de las razones por las que comenzó este proyecto era abogar por la participación en ensayos clínicos porque si tenemos pacientes que quieren llegar a conclusiones más rápido es una gran manera de ayudar a personas como usted hace.
Así que vamos a hacer una referencia a …¿ Cuándo sería el mejor momento para usar daratumumab con trasplante? ¿Como tratamiento de inducción o después del trasplante o …?
Dr. Plesner: En los planes que he visto, sería utilizado como parte del tratamiento de inducción, con carfilzomib, lenalidomida, dexametasona durante cuatro ciclos seguidos de dosis altas de melfalán y después una consolidación similar a la inducción con cuatro ciclos de Daratumumab carfilzomib, len + Dex y luego para el mantenimiento, puede ser solo Daratumumab o con lenalidomida. Creo que sería una combinación muy buena.
Jenny: Y vamos a hablar de la terapia de mantenimiento durante un minuto ya que la hemos mencionado . Por lo tanto, decías que daratmumab podría ser utilizado como un solo agente en la terapia de mantenimiento, Revlimid se utiliza también como terapia de modo que ¿se podrían combinar los dos y tal vez hacer un doblete para el tratamiento de mantenimiento?
Dr.Plesner: creo que la combinación de lenalidomida y daratmumab es extremadamente fuerte y creo que si se imagina que tienes pacientes que han pasado a la terapia de inducción, terapia de dosis alta y consolidación de entrar en el mantenimiento a continuación, mi mejor consejo que necesita ser explorado en ensayos de curso, pero mi consejo sería dar dara, len, Dex durante dos años. Y luego se detiene len / dex y se continua con dara.Esto necesita ser demostrado a través de ensayos clínicos, pero creo que este brazo sería el de mejor respuesta.
dara+bortezomib+dexa
Jenny: Eso sería su respuesta apuesta y como experto en daratmumab una muy buena opción. Sé que los ensayos clínicos validan todo eso, pero está genial escucharle. Y sé que cuando todos esos nuevos medicamentos fueron aprobados en noviembre pasado y daratumumab se incluyó en noviembre de 2015 se hizo un poco más difícil para los expertos de mieloma saber qué usar y en qué orden, qué momento y qué dosis y qué combinación así que es una gran sugerencia.
Hasta aquí la 1ªparte.
@teresaregueiro
Fuente Myeloma Crowd
Facebook CEMMp